急性髓系白血病 (AML) 主要在 60 岁以上的患者中诊断。最近生存率的改善仅限于患有 AML 的年轻成人。强化化疗,有或没有同种异体干细胞移植 (HSCT),仍然是所有成人(包括年龄较大、身体健康的患者)的 AML 护理标准。

最近,Raphael Itzykson发表在《blood》杂志一篇题目为“Genetic identification of patients with AML older than 60 years achieving long-term survival with intensive chemotherapy”的文章中。该研究显示ALFA 决策工具是一种简单、稳健且具有判别力的预后模型,适用于接受强化化疗的 60 岁以上 AML 患者。该模型可以指导将 7 + 3 标准护理与强度较低的方案进行比较的试验设计。
复发性细胞遗传学和遗传学病变是接受强化治疗的 AML 患者的关键预后因素,但致癌基因病变的预后价值主要在年轻成人中进行研究。 然而,主要的相互作用发生在年龄、肿瘤遗传学和治疗结果之间。老年患者 AML 的基因组景观也不同于年轻人。早期的研究侧重于NPM1或FLT3突变对老年 AML 患者的预后价值,包括研究小组进行的几项研究,已经询问了更广泛的复发性遗传病变的预后价值在这个人群中。然而,这些研究都没有可重复地确定患者的亚组,其结果对比足以指导强化化疗和替代研究方法之间的前期决策。
近年来,基于 7+3 的诱导化疗越来越受到强度较低的选择的挑战,特别是低甲基化剂和 venetoclax 的组合。为了设计适合老年 AML 患者的强化和较低强化治疗的未来随机研究,必须开发特定的决策工具来识别少数患者,其中 7 + 3 明确有益(“继续”)或无效(“ no-go”)在大多数年龄较大、身体健康的 AML 患者中(“慢动作”组)。
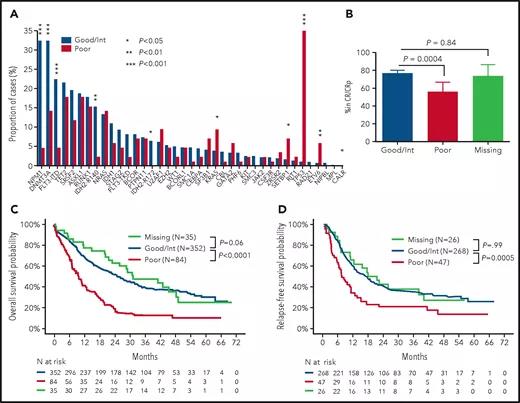
为了设计一个简单且可重复的分类器来预测 60 岁以上接受 7+3 治疗的急性髓系白血病 (AML) 患者的总生存期 (OS),研究团队对来自 ALFA1200(法国急性白血病协会)的 471 名患者的 37 个基因进行了测序研究(中位年龄,68 岁)。84 名细胞遗传学风险较差的患者与 387 名细胞遗传学风险良好 (n = 13)、中等 (n = 339) 或未测量 (n = 35) 细胞遗传学风险的患者的突变模式和 OS 不同。TP53(风险比 [HR],2.49;P = .0003)和KRAS(HR,3.60;P = .001)突变独立地使具有低风险细胞遗传学的患者的 OS 恶化。在没有低危细胞遗传学的患者中,NPM1 (HR, 0.57; P= .0004),具有低 (HR, 1.85; P = .0005) 或高 (HR, 3.51; P < 10 -4 ) 等位基因比率的FLT3内部串联重复,DNMT3A (HR, 1.86; P < 10 -4 ),NRAS(HR,1.54;P = .019)和ASXL1(HR,1.89;P = .0003)突变独立预测 OS。结合这 7 个基因的细胞遗传学风险和突变,39.1% 的患者可以被分配到“go-go”层,2 年 OS 为 66.1%,7.6% 到“no-go”组(2 年 OS 2.8%) 和 3.3% 的“慢走”组(2 年 OS 为 39.1%;P < 10 -5)。在 3 个独立的验证队列中,分别有 31.2% 至 37.7% 和 11.2% 至 13.5% 的患者被分配到开始和禁止阶段,所有 3 个试验队列(HDF [ Hauts-de-France],n = 141,P = .003;和 SAL [Study Alliance Leukemia],n = 46;AMLSG [AML Study Group],n = 223,P < 10 -5)。
在这项研究中,研究团队利用37个基因面板的结果在471例AML患者年龄≥60岁,并用强烈化疗的前瞻性,多中心,ALFA1200研究(在登记处理www.clincialtrials.gov为#NCT01966497)到设计一个非常简单的三层决策工具,研究团队在 3 个独立的队列中对其进行了验证。
这项研究依赖于对 471 名 60 岁以上的新诊断 AML 患者进行统一治疗的前瞻性队列中的 37 个基因的细胞遗传学和靶向测序。研究团队确定了强化化疗的短期(缓解)和长期(OS)益处的致癌预测因子。研究团队开发并验证了一个简单的决策模型,该模型考虑了 7 个基因(NPM1、FLT3- ITD、DNMT3A、NRAS、ASXL1、KRAS和TP53)的细胞遗传学和突变,可重复识别多个队列中总生存期存在显着差异的患者。
参考文献:
Genetic identification of patients with AML older than 60 years achieving long-term survival with intensive chemotherapy. Blood 2021; 138 (7): 507–519.