衰老是自然界的常见现象,伴随着生命周期中遗传损伤的累积,以及DNA损伤和修复之间失衡导致的基因突变。
机体衰老过程中出现九个特征:基因组不稳定性、端粒消耗、表观遗传改变、蛋白质稳态的丢失、营养吸收能力下降、线粒体异常、细胞衰老、干细胞耗竭、细胞通讯的改变。
衰老是细胞对内源性和外源性压力的反应,并限制了受损和衰老细胞的修复和更新。DNA损伤、端粒缩短、致癌损伤、代谢应激、染色质重塑、表观遗传学改变和线粒体功能障碍等有害刺激均可诱导其发生。衰老是一个动态的过程,渐进的,多步骤的,最终不可逆。
成体干细胞,存在于身体的不同组织中,为器官提供生长和再生的能力,以在其有生之年维持体内平衡。活着的有机体的再生能力取决于其干细胞取代受损组织或破损细胞的能力和潜力,故而干细胞的衰老,导致了机体整体的衰老。所有的衰老现象--组织退化--都可以被解释为机体干细胞水平上的衰老迹象。
成体干细胞的衰老
(一)造血干细胞(HSC)的衰老改变
俄国科学家Alexander A.Maximow在1908年柏林的一次血液病大会上的提出干细胞的概念,并于1909年正式发表阐述干细胞内涵的文章。但现代干细胞研究始于1963年,Lou Siminovitch团队建立了检测造血干细胞的方法,并在小鼠的骨髓中发现了造血干细胞(HSC)。

(恩大DIVA全自动液态样本分装系统+二氧化碳细胞培养箱)
1,免疫衰老
骨髓中的造血干细胞分化产生整个免疫系统的免疫细胞。适应性免疫系统无法产生保护性免疫,伴随着免疫系统的保真度(fidelity)和效能(efficiency)下降,被称为免疫衰老。免疫衰老的一个主要特征是炎症和抗炎网络之间的失衡,伴随着持续的低度炎症和对自身免疫反应的更大易感性。
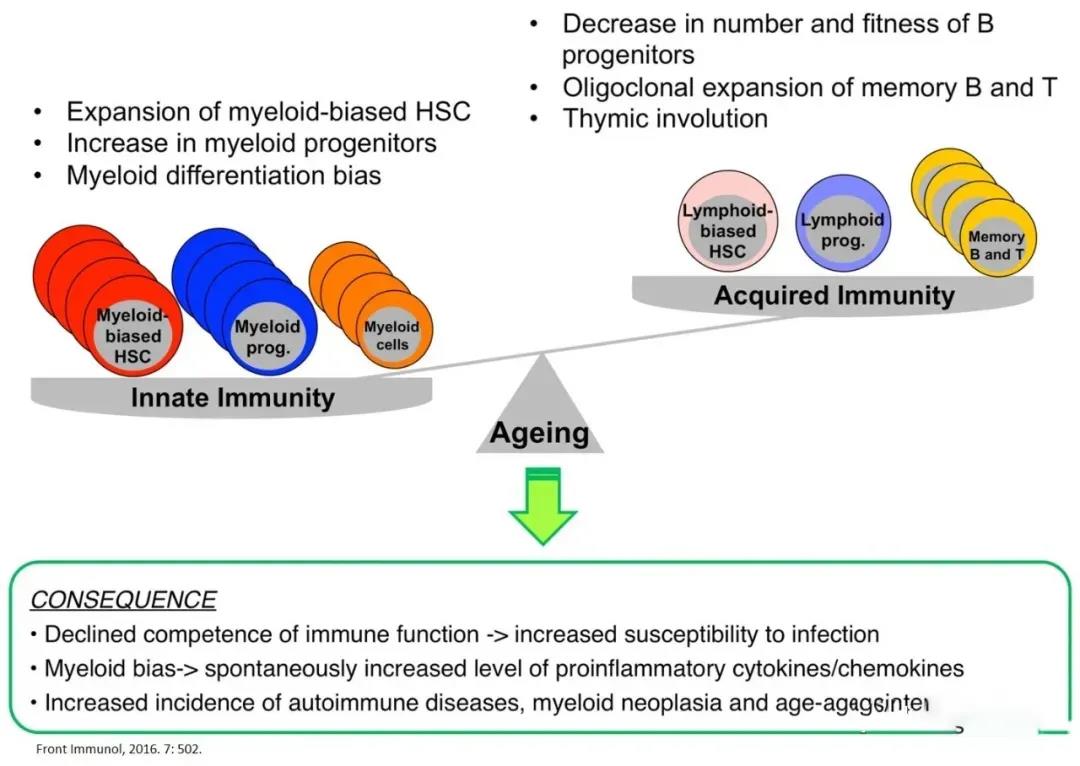
免疫系统的衰老,根源在于HSC的老化。造血系统的老化表现为适应性免疫系统和先天免疫系统的功能衰退,这种免疫细胞的衰老导致对病原微生物的高度易感性、疫苗接种的低效,以及对自身免疫和血液系统恶性肿瘤发展的易感性增加。通过T细胞和B细胞共缺陷小鼠移植HSC的实验,证明机体衰老时免疫系统的表型和功能变化主要是HSC在衰老过程中功能变化的结果,并且在很大程度上独立于胸腺的功能。
2,造血干细胞的衰老
大多数造血干细胞(HSC)在动态平衡状态下是静止的,很少进行周期自我更新或分化为子代的细胞。造血受到内在和外在机制的严格调控,这两种机制平衡了静止、自我更新和分化,以维持正常的多谱系细胞的稳定和系统重建。
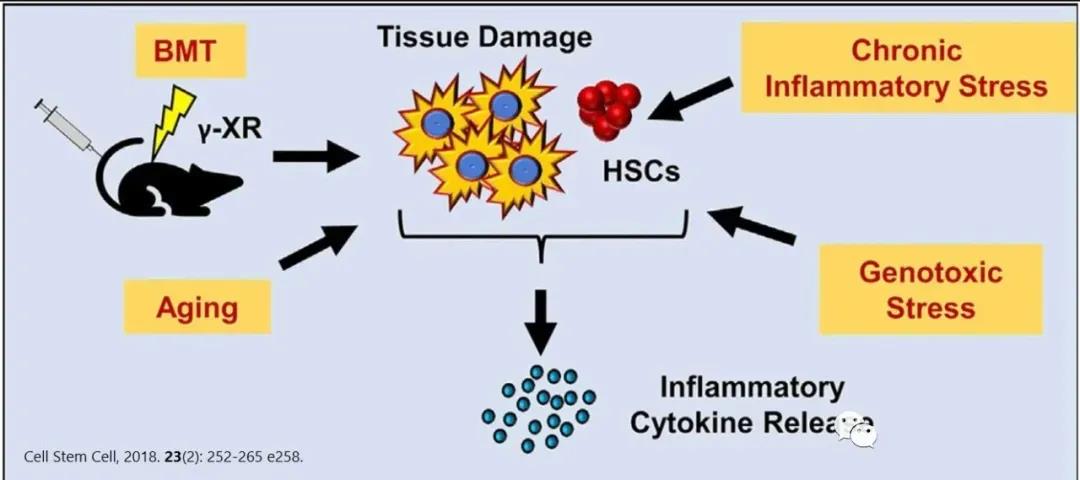
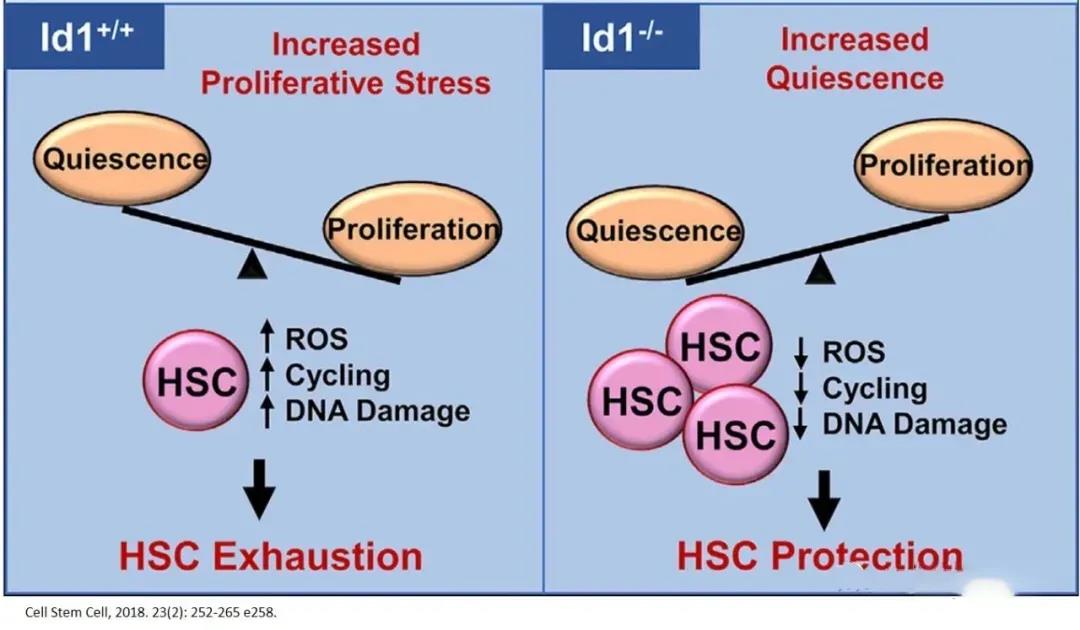
随着每一次细胞分裂,HSC分化为血细胞的潜能下降,同时,潜能降低的子代造血祖细胞数量增加,以弥补单个干细胞功能的丧失。因此,造血干细胞自身的大量增殖,会导致造血干细胞的耗竭;而静息状态有利于维持造血干细胞的功能和年轻态干性。在多种慢性和生理相关的应激状态下,DNA结合蛋白的抑制子1(Id1)的缺失可以保护HSC免于耗尽,并促进它们的静止,因而靶向Id1可能会改善HSC在慢性应激和衰老过程中的存活和功能。
(二)间充质干细胞(MSC)的衰老改变
1,年老MSC和年轻MSC的功能比较
人和小鼠一旦出生后,骨髓里面的MSC的含量持续下降,虽然身体机能在青春期达到巅峰,但是对于骨髓MSC来说,MSC出道面世即是颠峰!
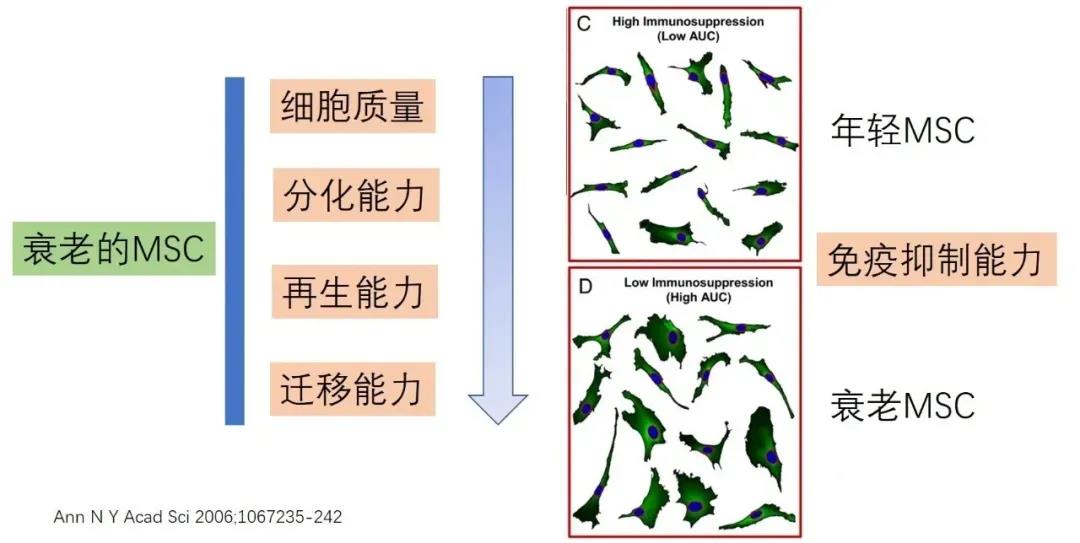
和年轻供体的MSC相比,年纪大的供体来源的MSC增殖能力明显下降,老龄MSC的胞体因为衰老而增大。而且年纪大的供体来源的表达SA-β-gal阳性MSC数量增多。MSC的抗氧化能力也随着年纪增大而逐渐下降。年龄相关衰老的骨髓MSC多种膜蛋白也表达下降:CD13、CD29、CD44、CD73、CD90、CD105、CD146和CD166。有意思的是,MSC的成脂/成骨/成软骨分化是MSC的一个基础特性,并不受年龄的影响。成骨分化的效率和MSC的多项分化能力没有必然的关联性。
肥胖者脂肪组织来源的MSC由于氧化和代谢应激的增加,这种应激影响脂肪MSC线粒体,导致DNA损伤、端粒缩短、增殖和干性减少(表现为NANOG、SOX2和OCT4的表达减少),增加凋亡和衰老。有趣的是,从皮下或内脏脂肪等不同解剖部位分离的脂肪MSC的功能特性出现不同程度的差异。肥胖环境还导致特定的DNA甲基化,导致线粒体形状和数量的变化,从而影响脂肪MSC细胞的功能特性,涉及脂肪生成、炎症和免疫抑制。与年轻的MSC共培养的巨噬细胞表达M2表型的标记Arg1和IL-10,而与衰老的骨髓MSC共培养的巨噬细胞表达M1相关的TNF-α。此外,年龄依赖性的脂肪生成增加,可能通过激活过氧化物酶体增殖物激活受体γ2(PPAR-γ2)和CCAAT/增强子结合蛋白(CCAAT/EBP)而导致SASP状态。
来自不同年龄捐赠者的BM-MSC的EV在其含量和免疫特征方面显示出显著的年龄差异。在小鼠模型中,来自年轻MSC的胞外囊泡(EV)含有更高水平的自噬相关mRNA和sirtuins,能使得衰老的造血干细胞(HSC)显示出恢复的功能和活力。相反,来自老年捐赠者的骨髓MSC释放SASP,促进了HSC的炎症状态而导致年轻HSC的功能损害。
2,MSC的年龄性衰老(老化)
MSC经过一定数量的细胞分裂后进入衰老,其形态学特征是细胞形态变大、不规则,最终停止增殖,而不适当的培养条件明显加速了这一过程。老化的MSC降低了多项分化潜能和组织修复所需的生长因子的产生。衰老和氧化应激可显著增加骨髓细胞外小泡的miR-183-5p载量,导致细胞增殖减少、成骨分化减少,并通过降低血红素加氧酶-1(Hmox1)活性介导MSC衰老。
衰老的MSC表现出克隆生成和增殖能力降低,分化潜能偏向脂肪生成而减弱了成骨生成。在体内,MSC衰老意味着成骨能力降低,从而导致与年龄相关的疾病,如骨质疏松症。因此,MSC老化被认为是骨折愈合随年龄增长而受损的原因。这也部分解释了为何老年人容易出现骨质酥松症,也解释了为何老年骨髓中的脂肪细胞增多。

MSC的年龄相关性细胞衰老有关,表现为增大、端粒缩短或p53/p21介导的DNA损伤堆积,DNA甲基化或组蛋白乙酰化受损,ROS和一氧化氮(NO)水平升高。DNA甲基转移酶(DNMT)抑制剂5-氮杂胞苷(5-AZA)逆转了MSC的衰老表型,细胞增殖率增加,氧化应激产物积聚减少,DNA甲基化状态降低。DNMT的抑制导致了活性状态的组蛋白标记的改变,并诱导了p16和p21启动子区域的CpG岛去甲基化,上调p16和p21的表达。所有这些数据表明,DNMTs和HDACs在调节MSC衰老中起着关键作用。
3,衰老相关分泌表型(SASP)
SASP是一种将细胞衰老与组织功能障碍联系起来的新机制。衰老细胞产生所谓的SASP分泌体,SASP通过自分泌/旁分泌调节环路来维持和放大衰老,涉及SASP产生细胞和周围细胞,即SASP负责将衰老传递到相邻细胞,从而引发致命的退行性疾病,并导致持续的低水平慢性炎症(定义为炎性衰老)。SASP呈现出一种动态的成分,包括促炎症细胞因子(如IL-1α、IL-1β、IL-6和IL-8)、趋化因子、生长因子和蛋白酶(如MMP-1、MMP-3和MMP-10),它们的组合取决于细胞类型、微环境和衰老诱导机制。
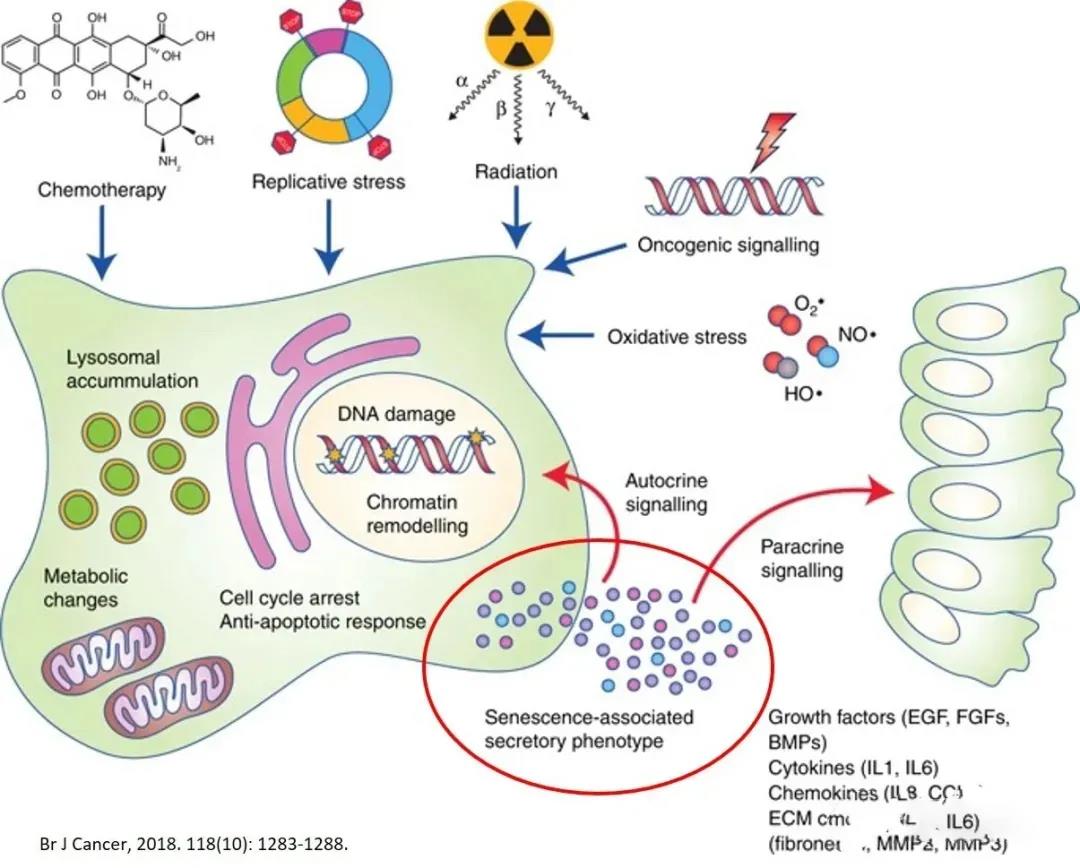
衰老的骨髓MSC出现SASP状态,过度释放SASP相关的外泌体,包括IL-6、IL-8、IFN-γ、单核细胞趋化蛋白-1(MCP-1)和基质金属蛋白酶(MMP-2、TIMP-2);由这些分泌分子引起的全身性炎症反应降低了MSC的免疫调节功能,促进了癌症进展。体内骨髓衰老的MSC成脂分化增强,而成骨分化减弱,同时分泌外泌体(miRNA-146a)和SASP,刺激巨噬细胞的极化从M2型向M1型转变,从而加剧了炎性衰老。
(三)衰老与炎症:炎性衰老(inflammaging)
组织和细胞在活体细胞周转和新陈代谢过程中产生的所有类型的物质,包括细胞碎片、代谢物、不完全降解或非酶处理的产物,被称为“分子垃圾”。为了处理分子垃圾和维持体内的动态平衡,已经开发出几种适应性策略,如识别PAMP或MAMP(微生物相关分子模式),它们可以直接激活模式识别受体(PRRs)和下游的炎症级联反应。动物中存在被称为“自噬/有丝分裂吞噬”的救援机制,也是为了避免体内细胞排泄物堆积不足,但是其功能在炎症环境中变得有缺陷,包括泛素蛋白酶体系统的失调和DNA损伤反应的激活等。

炎症是抵御有害物质入侵危及生命的一种防御机制,在儿童和成人时期维持内环境稳定,但慢性炎症是心血管疾病、糖尿病、癌症和阿尔茨海默病等年龄相关疾病的共同病理基础,并可能是增加老年人大多数退行性疾病的发病率和死亡率的重要危险因素。组织微环境的变化,如细胞碎片的积累,代谢和激素信号的系统性变化,也可能导致慢性炎症的发展。单核/巨噬细胞系细胞对这些与年龄相关的变化至关重要,这些变化最终导致慢性炎症性疾病的发展。
大多数与衰老相关的疾病都是由共同的和相互依存的条件导致的,这些条件包括:慢性低度炎症、大分子/细胞器功能障碍、干细胞功能障碍和衰老细胞堆积。在动物模型中遗传和药物消除衰老细胞可以延长寿命并延缓与年龄相关的病理的发生。细胞水平上的衰老可能是炎症的原因。随着年龄的增长,组织中积累的衰老细胞分泌促炎细胞因子,即为“衰老相关分泌表型”(SASP),有助于炎症的发生。因此,长期以来,炎症一直被认为是许多组织癌症发展的驱动力。所以,消炎很重要!
版权声明
我们尊重分享,文章、图片均来源自网络,版权归原作者所有。如有异议,请联系本篇作者(或平台客服),我们会及时处理。